Labels
- a-hot
- a-update
- Android OS
- cach lam
- cách làm
- Chế Lan Viên
- Chí Phèo
- Code
- Danh ngôn cuộc sống
- Đoremon Chế
- Đồ họa
- Funny
- Game hay
- Game Mobile
- Hãy hướng về phía mặt trời bóng tối sẽ ngả về sau bạn
- Hóa học
- iOS (Apple)
- Java OS
- Kinh Nghiệm Thủ thuật
- lam van nghi luan
- làm văn nghị luận
- Mẹ và quả
- Nam Cao
- nghi luan van hoc
- nghi luan xa hoi
- nghị luận văn học
- Nghị luận VH
- Nghị luận VH về TP Thơ
- Nghị luận VH về TP truyện
- Nghị luận xã
- Nghị luận xã hội
- Nghị luận XH
- Nghị luận XH về TTĐL
- ngu van 10
- ngu van 11
- Nguyễn Hồi Thủ
- Nguyễn Khoa Điềm
- Niềm tin cuộc sống
- ôn thi đại học
- Phần mềm
- Projects After Effects
- Quá trình tha hóa và thức tỉnh của nhân vật Chí Phèo
- Share Style ProShow
- Share Sub và Fx
- Sợi tóc nhỏ
- Sự cẩu thả trong bất cứ nghề gì cũng là một sự bất lương
- Sứ mạng của người mẹ
- Tài liệu
- Thái độ cần có khi chọn nghề
- thơ
- Tiếng hát con tàu
- Tôi đã khóc khi không có giày để đi cho đến khi tôi nhìn thấy một người không có chân để đi giày
- Trích dẫn thơ hay
- Truyện Ngắn
- Tư tưởng Đất Nước của Nhân dân
- Văn học
- văn mẫu
Bài đăng phổ biến
-
PHP Designer là một công cụ lập trình PHP chuyên nghiệp và khá nỗi tiếng trong giới lập trình ở cả Việt Nam và thế giới. PHP Designer là ...
-
Download Rèn Kỹ Năng Giải Toán Trắc Nghiệm 12 Download Click here Trần Đình Thì
-
+ Share Intro ProShow giới thiệu đơn giản PART 11 + FREE 2D Intro Template After Effects 2D Intro Template Demo : FREE INTRO PROSHOW GIỚI TH...
-
Hướng dẫn giải một số bài PEPTIT khó năm 2016 -Nguyễn Công Kiệt - Bookgol.com Tài liệu gồm 28 trang Phần 1: Một số câu peptit trong đề th...
-
SHARE FREE STYLE PROSHOW LOVE STORY PHOTO GALLERY DOWNLOAD STYLE PROSHOW LOVE STORY PHOTO GALLERY ( Nhớ Ấn Subcrise + Like nhé ) PASS : Phuo...
-
DEMO : FREE INTRO PROSHOW GIỚI THIỆU PART 10 ( Nhớ Ấn Subcrise + Like nhé ) PASS : PhuongUyen
-
Hướng dẫn kích hoạt công cụ Data Analysis trong Excel Bạn đang cần bật tính năng Data Analysis trong Excel? Đối với phiên bản Office 2003 t...
-
Em hãy Tả sân trường giờ ra chơi . Cả lớp đang chăm chú nghe cô giáo giảng bài. Ngoài sân trường chỉ nghe thấy tiếng gió vi vu thổi và tiến...
Nhãn
- a-hot
- a-update
- Android OS
- cach lam
- cách làm
- Chế Lan Viên
- Chí Phèo
- Code
- Danh ngôn cuộc sống
- Đoremon Chế
- Đồ họa
- Funny
- Game hay
- Game Mobile
- Hãy hướng về phía mặt trời bóng tối sẽ ngả về sau bạn
- Hóa học
- iOS (Apple)
- Java OS
- Kinh Nghiệm Thủ thuật
- lam van nghi luan
- làm văn nghị luận
- Mẹ và quả
- Nam Cao
- nghi luan van hoc
- nghi luan xa hoi
- nghị luận văn học
- Nghị luận VH
- Nghị luận VH về TP Thơ
- Nghị luận VH về TP truyện
- Nghị luận xã
- Nghị luận xã hội
- Nghị luận XH
- Nghị luận XH về TTĐL
- ngu van 10
- ngu van 11
- Nguyễn Hồi Thủ
- Nguyễn Khoa Điềm
- Niềm tin cuộc sống
- ôn thi đại học
- Phần mềm
- Projects After Effects
- Quá trình tha hóa và thức tỉnh của nhân vật Chí Phèo
- Share Style ProShow
- Share Sub và Fx
- Sợi tóc nhỏ
- Sự cẩu thả trong bất cứ nghề gì cũng là một sự bất lương
- Sứ mạng của người mẹ
- Tài liệu
- Thái độ cần có khi chọn nghề
- thơ
- Tiếng hát con tàu
- Tôi đã khóc khi không có giày để đi cho đến khi tôi nhìn thấy một người không có chân để đi giày
- Trích dẫn thơ hay
- Truyện Ngắn
- Tư tưởng Đất Nước của Nhân dân
- Văn học
- văn mẫu
Mẹo hay
Bình luận mới
Technology
Breaking News
tháng 1 2016
a-hot
a-update
Android OS
cach lam
cách làm
Chế Lan Viên
Chí Phèo
Code
Danh ngôn cuộc sống
Đoremon Chế
Đồ họa
Funny
Game hay
Game Mobile
Hãy hướng về phía mặt trời bóng tối sẽ ngả về sau bạn
Hóa học
iOS (Apple)
Java OS
Kinh Nghiệm Thủ thuật
lam van nghi luan
làm văn nghị luận
Mẹ và quả
Nam Cao
nghi luan van hoc
nghi luan xa hoi
nghị luận văn học
Nghị luận VH
Nghị luận VH về TP Thơ
Nghị luận VH về TP truyện
Nghị luận xã
Nghị luận xã hội
Nghị luận XH
Nghị luận XH về TTĐL
ngu van 10
ngu van 11
Nguyễn Hồi Thủ
Nguyễn Khoa Điềm
Niềm tin cuộc sống
ôn thi đại học
Phần mềm
Projects After Effects
Quá trình tha hóa và thức tỉnh của nhân vật Chí Phèo
Share Style ProShow
Share Sub và Fx
Sợi tóc nhỏ
Sự cẩu thả trong bất cứ nghề gì cũng là một sự bất lương
Sứ mạng của người mẹ
Tài liệu
Thái độ cần có khi chọn nghề
thơ
Tiếng hát con tàu
Tôi đã khóc khi không có giày để đi cho đến khi tôi nhìn thấy một người không có chân để đi giày
Trích dẫn thơ hay
Truyện Ngắn
Tư tưởng Đất Nước của Nhân dân
Văn học
văn mẫu
Tổng hợp bài giảng toán C2 ( Toán cao cấp)
Bài giảng được thực hiện bởi thầy : Lê Văn Thực
Phát tất cả tại : https://www.youtube.com/watch?v=PRNEjwCyKzc&list=PLm0RVEt7mXipztXag0f4o7KGzc1Z3AFoM&index=3
Bài 1 + 2 : Ma trận
Bài 05+06: Định thức ma trận vuông
Phát tất cả tại : https://www.youtube.com/watch?v=PRNEjwCyKzc&list=PLm0RVEt7mXipztXag0f4o7KGzc1Z3AFoM&index=3
Bài 1 + 2 : Ma trận
Bài 3 + 4 :
Bài 05+06: Định thức ma trận vuông
Share Intro Proshow giống DamTv
Demo intro proshow giống Damtv :
Share PSD logo tết 2016
Hướng dẫn :
*Tải 2 font + UTM Aircona
+HP-Arabia
*Cài đặt font :
C1 : Vào My Computer, copy font bạn muốn cài vào thư mục C:\Windows\Fonts.
Coppy font vào thư mục fonts
C2 :
Các bạn có thể cài đặt trực tiếp font chữ bằng cách click
vào các font chữ đó rồi chuột phải chọn Install
* Cài đặt và mở PTS
Bạn file=>open=>tìm file psd bạn vừa Dowload ở trên =>ok
*Sau đó nó sẽ hiên ra hình logo như demo , ấn chữ T trên bàn phím
*Click vào chữ 2hi Blog và thay chữ khác vào !
Demo :
Download PSD logo Tết 2016
Bạn nào thực sự thích mà không làm được , hoặc không có máy tính thì bình luận dưới bài viết mình sẽ làm giúp nhé ! ( Chỉ cần ấn nút Like thay lời cám ơn là được ) ^^!
*Tải 2 font + UTM Aircona
+HP-Arabia
*Cài đặt font :
C1 : Vào My Computer, copy font bạn muốn cài vào thư mục C:\Windows\Fonts.
Coppy font vào thư mục fonts
C2 :
Các bạn có thể cài đặt trực tiếp font chữ bằng cách click
vào các font chữ đó rồi chuột phải chọn Install
* Cài đặt và mở PTS
Bạn file=>open=>tìm file psd bạn vừa Dowload ở trên =>ok
*Sau đó nó sẽ hiên ra hình logo như demo , ấn chữ T trên bàn phím
*Click vào chữ 2hi Blog và thay chữ khác vào !
Demo :
Link Tải:
Share Sub Những đứa bạn - Suboi
Các bạn xem demo ở phút thứ 3:25 nha.
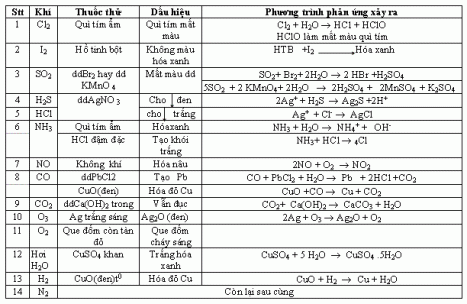
CÁCH NHẬN BIẾT MỘT SỐ KHÍ
Ví dụ: Bằng phương pháp hoá học, hãy nhận biết các khí sau:
a) Cl2, O2, HCl, N2
– Dùng quì tím ẩm:
+ Nhận được Clo ( do quì tím mất màu)
+ Nhận được HCl ( do quì tím hoá đỏ)
– Dùng que đốm còn tàn đỏ:
+ Nhận được O2 ( do que đốm bùng cháy)
+ Nhận được N2 ( que đốm tắt)
b) O2, O3, SO2, CO2
– Dùng dung dịch Br2: Nhận được SO2 ( do làm mất màu dd Br2)
SO2 + Br2 + 2H2O -> 2HBr + H2SO4
– Dùng nước vôi trong ( dd ca(OH)2): nhận được CO2 ( làm đục nước vôi trong)
CO2 + Ca(OH)2 -> CaCO3 + H2O
– Dùng lá Ag ( hoặc dd KI thêm ít hồ tinh bột): nhận được O3 ( làm lá Ag chuyển sang màu đen (hoặc xuất hiện dd màu xanh ))
2Ag + O3 -> Ag2O + O2
hoặc (O3 + 2KI + H2O -> 2KOH + O2 + I2; I2 + htb -> xuất hiện màu xanh)
– Còn lại không hiện tượng là O2
* LƯU Ý:
– KHÔNG DÙNG QUE ĐỐM ĐỂ PHÂN BIỆT O2 VÀ O3 VÌ KHI CHO QUE ĐỐM VÀO O2 VÀ O3, QUE ĐỐM ĐỀU CHÁY SÁNG.
– KHÔNG DÙNG NƯỚC VÔI TRONG ( DD Ca(OH)2 ĐỂ PHÂN BIỆT SO2 VÀ CO2 VÌ CẢ CO2 VÀ SO2 ĐỀU LÀM ĐỤC NƯỚC VÔI TRONG
SO2 + Ca(OH)2 -> CaSO3 + H2O
BÀI TẬP ÁP DỤNG:l
Hãy nhận biết các chất khí sau:
a) Cl2, SO2, CO2, H2S
b) O2, Cl2, HCl, N2, H2
c) Cl2, CO2, HCl, N2
d) O2, O3, Cl2, H2, N2
Giải bài tập hóa học lớp 8 - Trang 151 SGK
1. Các kí hiệu sau cho chúng ta biết những điều gì ?
a) 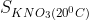 =31,6 g;
=31,6 g; 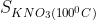 =246 g
=246 g
b) 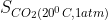 =1,73 g;
=1,73 g; 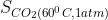 =0,07 g
=0,07 g
Bài giải:
a) + Ở 200C độ tan của KNO3 là 31,6 g; Ở 1000C độ tan của KNO3 là 246 g
+ Ở 200C độ tan của CuSO4 là 20,7 g; Ở 1000C độ tan của CuSO4 là 75,4 g
b) Ở 200C và 1 atm độ tan của khí cacbonic là 1,73 g; Ở 600C và 1atm độ tan của khí cacbonic là 0,07 g
2. Bạn em đã pha loãng axit bằng cách rót từ từ 20 g dung dịch H2SO4 50% vào nước và sau đó thu được 50 g dung dịch H2SO4
a) Tính nồng độ phần trăm của dung dịch H2SO4 sau khi pha loãng
b) Tính nồng độ mol của dung dịch H2SO4 sau khi pha loãng, biết dung dịch này có khối lượng riêng là 1,1 g/cm3.
Bài giải:
a) Khối lượng H2SO4 là: m =10 g
Nồng độ phần trăm dung dịch H2SO4 sau khi pha loãng là:
C% = 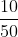 . 100% =20%
. 100% =20%
b) Thể tích dung dịch H2SO4 là: V =45,45 ml
Số mol của H2SO4 là: n =0,102 mol
Nồng độ mol của dung dịch H2SO4 sau khi pha loãng:
CM = 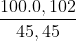 =2,24 (mol/lít)
=2,24 (mol/lít)
3. Biết 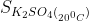 =11,1 g. Hãy tính nồng độ phẩn trăm của dung dịch K2SO4 bão hòa ở nhiệt độ này.
=11,1 g. Hãy tính nồng độ phẩn trăm của dung dịch K2SO4 bão hòa ở nhiệt độ này.
Bài giải:
Nồng độ phần trăm của dung dịch K2SO4 bão hòa ở nhiệt độ 200C là:
C% = 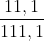 . 100% =9,99%
. 100% =9,99%
5. Hãy trình bày cách pha chế:
a) 400 g dung dịch CuSO4 4%.
b) 300 ml dung dịch NaCl 3M.
Bài giải:
a) Khối lượng chất tan là:
m = 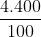 =16 g
=16 g
Khối lượng dung môi:
mdm =mdd – mct =400 – 16 =384 g
Cách pha chế: Cần lấy 16 g CuSO4 khan (màu trắng) cho vào cốc có dung tích 100 ml. Cần lấy 384 g nước cất rồi đổ dần dần vào cốc và khuấy kĩ cho CuSO4 tan hết. Ta được 400 g dung dịch CuSO4 4%
b) Số mol chất tan:
n =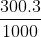 = 0,9 mol
= 0,9 mol
Khối lượng của 0,9 mol NaCl
m =58,5 x 52,65 (g)
Cách pha chế:
Cân lấy 52,65 g NaCl cho vào cốc thủy tinh. Đổ dần dần nước cất vào và khuấy nhẹ đủ 300 ml. Ta được 300 ml dung dịch CuSO4 3M
6. Hãy trình bãy cách pha chế:
a) 150 g dung dịch CuSO4 2% từ dung dịch CuSO4 20%
b) 250 ml dung dịch NaOH 0,5 M từ dung dịch NaOH 2M
Bài giải:
a) Khối lượng chất tan có trong 150 g dung dịch CuSO4 2%:
m =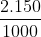 = 3 g
= 3 g
Khối lượng dung dịch CuSO4 ban đầu có chứa 3 g CuSO4:
mdd =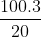 = 15 g
= 15 g
Khối lượng nước cần pha chế là: mnước =150 – 15 =135 g
Pha chế: lấy 15 g dung dịch CuSO4 20% vào cốc thêm 135 g H2O vào và khuấy đều, được 150 g dung dịch CuSO42%
b) Số mol chất tan trong 250 ml dung dịch NaOH 0,5M
n =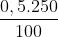 = 0,125 mol
= 0,125 mol
Thể tích dung dịch NaOH 2M có chứa 0,125 mol NaOH là:
V =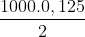 = 62,5 ml
= 62,5 ml
Pha chế: Đong lấy 62,5 ml dung dịch NaOH 2M cho vào cốc chia độ có dung tích 500ml. Thêm từ từ nước cất vào cốc đến vạch 250 ml và khuấy đểu ta được 250 ml dung dịch 0,5M
Giải bài tập hóa học lớp 8 - Trang 60 - 61 SGK
1. Hình dưới đây là sơ đồ tượng trưng cho phản ứng: giữa khí N2 và khí H2 tạo ra amoniac NH3.
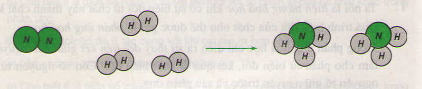
N2 + 3H2 => NH3 (tham khảo sơ đồ bài 1, trang 61/ sgk)
Hãy cho biết
a) Tên các chất tham gia và sản phẩm của phản ứng?
b) Liên kết giữa các nguyên tử thay đổi như thế nào? Phân tử nào biến đổi, phân tử nào được tạo ra?
c) Số nguyên tử mỗi nguyên tố trước và sau phản ứng bằng bao nhiêu, có giữ nguyên không?
Hướng dẫn giải:
a) + Chất tham gia: khí nitơ, khí hidro
+ Sản phẩm: khí amoniac
b) Trước phản ứng, hai nguyên tử hidro liên kết với nhau. Sau phản ứng , ba nguyên tử hidro liên kết với một nguyên tử ni tơ.
Phân tử hidro và nguyên tử ni tơ biến đổi, phân tử amoniac được tạo ra.
c) Số nguyên tử mỗi nguyên tố trước và sau phản ứng đối với hidro là 6 đối với nitơ là 2, vẫn không thay đổi trước và sau phản ứng.
2. Khẳng định sau gồm hai ý: “ Trong phản ứng hóa học , chỉ phân tử biến đổi còn các nguyên tử giữ nguyên, nên tổng khối lượng các chất phản ứng được bảo toàn’’.
Hãy chọn phương án đúng trong số các phương án sau:
A. Ý 1 đúng, ý 2 sai;
B. Ý 2 đúng, ý 1 sai
C. Cả 2 ý đều đúng, nhưng ý 1 không giải thích cho ý 2;
D. Cả 2 ý đều đúng, nhưng ý 1 giải thích cho ý 2;
E. Cả 2 ý đều sai.
Hướng dẫn giải:
Câu d đúng.
3. Canxi cacbonat (CaCO3) là thành phần chính của đá vôi. Khi nung đá vôi xẩy ra phản ứng hóa học sau:
Canxi cacbonat à Canxi oxit + Canbon đioxit
Biết rằng khi nung 280kg đá vôi tạo ra 140kg canxi CaO (vôi sống) và 110kg khí cacbon đioxit CO2.
a) Viết công thức về khối lượng phản ứng.
b) Tính tỉ lệ phần trăm về khối lượng canxi cacbonat chứa trong đá vôi.
Hướng dẫn giải
a) Công thức về khối lượng phản ứng:
mCaCO3 =mCaO + mCO2
b) mCaCO3 =140 + 110 =250 kg
=> %CaCO3
= 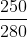 =89,28%.
=89,28%.
4. Biết rằng khí etilen C2H4 cháy là xẩy ra phản ứng với khí oxi O2, sinh ra khí cacbon đioxit CO2 và nước.
a) Lập phương trình hóa học của phản ứng.
b) Cho biết tỉ lệ giữa số phân tử etilen lần lượt với số phân tử oxi và số phần tử cacbon đioxit.
Hướng dẫn giải:
a) Phương trình hóa học phản ứng:
C2H4 + 3O2 -> 2CO2 + 2H2O
b) Tỉ lệ giứa số phân tử etilen lần lượt với số phân tử oxi và số phần tử cacbon đioxit
+ Phân tử etilen : phân tử oxi =1:3
+ Phân tử etilen : phân tử cacbonđioxit =1:2
5. Cho sơ đồ phản ứng sau:
Al + CuSO4 à Alx(SO4)y + Cu
a) Xác định các chỉ số x,y.
b) Lập phương trình hóa học cho biết tỉ lệ số nguyên tử của cặp đơn chất kim loại, số phân tử của cặp hợp chất.
Hướng dẫn giải:
a) Alx(SO4)y
Ta có : 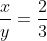 => x =2; y =3
=> x =2; y =3
-> Al2(SO4)3
b) Phương trình hóa học:
2Al + 3CuSO4 -> Al2(SO4)3 + 3Cu
Tỉ lệ nguyên tử của cặp đơn chất kim loại trong phản ứng trên là tỉ lệ của nhôm và đồng:
Nguyên tử Al: nguyên tử Cu =2:3.
Giải Bài tập hóa học 8 - Trang 100 -101
Bài tập hóa học 8 - Trang 100 -101
Bài 1 : /100 hóa học lớp 8
Viết phương trình hóa học biểu diễn sự cháy của các đơn chất trong oxi1. Viết phương trình hóa học biểu diễn sự cháy của các đơn chất trong oxi : cacbon, photpho, hiđro, nhôm biết rằng sản phẩm lần lượt là những hợp chất lần lượt có công thức hóa học : CO2, P2O5, H2O, Al2O3. Hãy gọi tên các chất tao thành.
Hướng dẫn.
C + O2 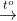 CO2
CO2
4P + 5O2 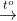 2P2O5
2P2O5
2H2 + O2 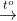 2H2O
2H2O
4Al + 3O2 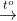 2Al2O3
2Al2O3
Gọi tên :
+ CO2 : khí cacbonic ;
+ P2O5 : đi photpho pentaoxit ;
+ H2O : nước ;
+ Al2O3 : nhôm oxit.
Bài 2 /100 - Hóa học lớp 8
Những biện pháp phải thực hiện để dập tắt sự cháy là gì ? Tại sao nếu thực hiện được các biện pháp ấy thì sẽ dập tắt được sự cháy ?
2. Những biện pháp phải thực hiện để dập tắt sự cháy là gì ? Tại sao nếu thực hiện được các biện pháp ấy thì sẽ dập tắt được sự cháy ?
Hướng dẫn.
Biện pháp dập tắt sự cháy :
+ Hạ nhiệt độ của chất cháy xuống dưới nhiệt độ cháy ;
+ Cách li chất cháy với oxi
Khi thực hiện được các biện pháp trên sẽ dập tắt được sự cháy vì khi đó điều kiện để sự cháy diễn ra đã không còn và dĩ nhiên sự cháy không thể tiếp tục được nữa.
Bài 3 /101 - Hóa học lớp 8
3. Các oxit sau đây thuộc loại oxit axit hay oxit bazơ ? Vì sao ?
Na2O, MgO, CO2, Fe2O3, SO2, P2O5
Gọi tên các oxit đó.
Hướng dẫn.
+ Oxit axit : CO2 (cacbon đioxit), SO2 (lưu huỳnh đioxit), P2O5 (điphotpho pentaoxit). Vì các oxit của phi kim và có những axit tương ứng.
+ Oxit bazơ : Na2O ( natri oxit),MgO(magie oxit), Fe2O3 (sắt III oxit). Vì các oxit là các oxit của kim loại và có những bazơ tương ứng.
Bài 4 /101 - Hóa học lớp 8
4. Khoanh tròn ở đầu những câu phát biểu đúng :
Oxit là hợp chất của oxi với :
a. Một nguyên tố kim loại ;
b. Một nguyên tố phi kim khác ;
c. Các nguyên tố hóa học khác ;
d. Một nguyên tố hóa học khác ;
e. Các nguyên tố kim loại.
Hướng dẫn.
Câu d. đúng.
Bài 6 /101 - Hóa học lớp 8
6. Hãy cho biết những phản ứng sau đây thuộc loại phản ứng hóa hợp hay phản ứng phân hủy ? Tại sao ?
a) 2KMnO4 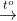 K2MnO4 + MnO2 + O2
K2MnO4 + MnO2 + O2
b) CaO + CO2 -> CaCO3
c) 2HgO -> 2Hg + O2
d) Cu(OH)2 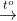 CuO + H2O
CuO + H2O
Hướng dẫn.
a) Phản ứng phân hủy vì từ một chất KMnO4 phân hủy thành ba chất khác nhau.
b) Phản ứng hóa hợp vì từ hai chất CaO và CO2 tạo thành sản phẩm duy nhất CaCO3.
c) Phản ứng phân hủy vì từ một chất đầu tiên HgO sinh ra hai chất sau phản ứng.
d) Phản ứng phân hủy vì từ Cu(OH)2 phân hủy thành hai chất CuO và nước.
MKRdezign
Được tạo bởi Blogger.